Cancer de l'ovaire
À la une
Lynparza® remboursé dans le cancer du sein précoce
À partir du 1er juillet 2023, Lynparza® (olaparib) est remboursé pour le traitement adjuvant des adultes atteints d'un cancer du sein au stade précoce HER2-négatif à haut risque et présentant une mutation germinale des gènes BRCA1/2, après avoir été précédemment traité par chimiothérapie (anthracycline et/ou taxane) au stade (néo)adjuvant.2
Informations de prescription
Indications thérapeutiques dans le cancer de l’ovaire
Lynparza® est indiqué en monothérapie pour le :
- Traitement d’entretien des patientes adultes atteintes d’un cancer épithélial avancé (stades FIGO III et IV) de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif avec mutation des gènes BRCA1/2 (germinale et/ou somatique) et qui sont en réponse partielle ou complète à une première ligne de chimiothérapie à base de platine.
- Traitement d'entretien des patientes adultes atteintes d’un cancer épithélial de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif, récidivant et sensible au platine et qui sont en réponse (complète ou partielle) à une chimiothérapie à base de platine.
Lynparza® en association au bévacizumab est indiqué pour le:
- Traitement d’entretien des patientes adultes atteintes d’un cancer épithélial avancé (stades FIGO III et IV) de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif et qui sont en réponse partielle ou complète à une première ligne de traitement associant une chimiothérapie à base de platine au bévacizumab et dont le cancer est associé à un statut positif de la déficience en recombinaison homologue (HRD), défini par une mutation des gènes BRCA1/2 et/ou une instabilité génomique.
Dosage et administration
Recommandations de dosages pour Lynparza® comprimés pelliculés1
Remboursement en Belgique
Olaparib fait l’objet d’un remboursement s’il est administré en monothérapie pour le traitement d'entretien des patientes adultes atteintes d’un cancer épithélial avancé de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif nouvellement diagnostiqué avec mutation BRCA et qui sont en réponse à une première ligne de chimiothérapie à base de platine.2
Il s’agit d’une patiente2:
- atteinte d’un cancer épithélial stade FIGO III ou IV de l’ovaire, des trompes de Fallope ou péritonéal primitif nouvellement diagnostiqué
- Et avec une histologie de haut grade confirmée
- Et avec une mutation délétère confirmée ou suspecté du gènes BRCA1 et/ou 2 (germinale et/ou somatique)
- Et qui a terminé sa dernière dose de chimiothérapie de première intention à base de platine pas plus de 8 semaines avant le début du traitement par olaparib
- Et qui est en réponse à la chimiothérapie de première intention à base de platine récemment arrêtée, à savoir :
- soit en réponse complète, étant aucune maladie mesurable à l’imagerie après chimiothérapie et un niveau normal de CA-125,
- soit en réponse partielle, étant une diminution du volume de la tumeur de > ou = 30% par imagerie entre le début et la fin de la chimiothérapie ou aucune maladie mesurable par imagerie après la chimiothérapie et un taux de CA-125 qui n’est pas tombé au niveau normal
Olaparib fait l’objet d’un remboursement de continuation après 2 ans de traitement d’entretien conformément au § 10210100 s’il est administré en monothérapie pour le traitement d'entretien de ces patientes atteintes d’un cancer épithélial avancé de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif résiduel stable et qui sont en réponse à une première ligne de chimiothérapie à base de platine.
Il s’agit d’une patiente:
- Pour laquelle une imagerie médicale appropriée (CT-scan ou IRM), réalisée 2 ans après la demande de remboursement conformément au § 10210100, a démontré la présence d’une maladie restante stable et les mesures en série de CA-125 ne montrent pas de rechute
- Et qui, selon l’avis du médecin traitant, peuvent tirer un bénéfice de la poursuite du traitement
La spécialité pharmaceutique à base d’olaparib fait l’objet d’un remboursement conformément au § 10950000 si elle est administrée en monothérapie dans le cadre du traitement d'entretien des bénéficiaires adultes atteints d’un cancer épithélial séreux ou endométrioïde de haut grade de l'ovaire, des trompes de Fallope ou péritonéal primitif, récidivant et sensible au platine avec une mutation du gène BRCA, n’ayant jamais été traités par une spécialité pharmaceutique à base d’olaparib ou un autre inhibiteur de PARP dans une ligne préalable.
Le bénéficiaire doit avoir reçu au minimum 2 lignes d’une chimiothérapie à base de platine et doit être en réponse complète ou réponse partielle (selon les critères RECIST) à la dernière chimiothérapie à base de platine administrée et cela jusqu’à la fin de la chimiothérapie.
L’intervalle entre l’avant-dernière ligne de chimiothérapie à base de platine et la progression de la maladie est d’au moins 6 mois.
Ceci concerne:
- Un bénéficiaire n’ayant jamais été traité par une spécialité pharmaceutique à base d’olaparib ou par un autre inhibiteur de PARP : le bénéficiaire ne peut pas avoir terminé sa dernière ligne de chimiothérapie à base de platine plus de 8 semaines avant le début du traitement par la spécialité pharmaceutique concernée
- OU un bénéficiaire ayant déjà eu une première autorisation de remboursement pour la spécialité pharmaceutique à base d’olaparib (§7770000) avant l’entrée en vigueur de la présente règlementation.
Une mutation délétère confirmée ou suspectée du gène BRCA (germinale et/ou somatique) doit être indiquée par un centre agréé pour la génétique humaine ou par un NGS-réseau qui a adhéré à la convention avec l’INAMI.
Cliquez ici pour soumettre une demande de remboursement électronique via la plateforme eHealth.
À propos de Lynparza
Mécanisme d’action
L’olaparib est un puissant inhibiteur des enzymes poly (ADP-ribose) polymérase humaines (PARP-1, PARP-2 et PARP-3) et il a été montré qu'il inhibait la croissance de certaines lignées de cellules tumorales in vitro et la croissance tumorale in vivo soit en monothérapie soit en association avec des chimiothérapies de référence.1
Pour résumer: Les tumeurs présentant une mutation des gènes BRCA (BRCAm) ont une biologie moléculaire unique qui les rend sensibles à l'inhibition de la PARP.3,4
Lynparza® inhibe la PARP de deux façons:*3-5
- En inhibant l’activité enzymatique3-5
- En augmentant la formation de complexes PARP-ADN piégés3-5
In vitro activity does not always correlate with clinical efficacy.
*The exact mechanism of action of LYNPARZA remains a subject of research.
PARP=poly (ADP-ribose) polymerase; PARPi=poly (ADP-ribose) polymerase inhibitor.
Résumé des résultats 1ère ligne
SOLO-1: Lynparza® monothérapie
Analyse descriptive de la survie globale après 7 ans de suivi
Un avantage cliniquement pertinent en termes de survie globale a été observé avec l'olaparib par rapport au placebo : 67% des patientes sous Lynparza® étaient en vie après 7 ans contre 46,5% des patientes sous placebo13.
*P<0.0001 required to declare statistical significance. In order to preserve the statistical power of the final OS analysis, the alpha spending function required a p < .0001 to show statistical significance in the descriptive analysis (administrative alpha spending)13
BRCAm=BRCA-mutated; CI=confidence interval; HR=hazard ratio; mOS=median overall survival; OS=overall survival.
Time to first subsequent treatment (TFST): un traitement d'entretien avec Lynparza® a retardé le délai avant le traitement suivant ou le décès par rapport au placebo. Le délai médian jusqu'au traitement suivant ou au décès était de plus de 4 ans avec Lynparza® contre plus d'un an avec le placebo.13
5-year analysis of progression-free survival7:
Lynparza® en monothérapie: SSP médiane de >4,5 ans chez les patientes atteintes d'un cancer de l'ovaire avancé et présentant unBRCAm.6,7
Analyse primaire de la SSP après 3 ans de suivi :
Ci-dessous, le Professeur Jean-François Baurain (oncologue médical aux cliniques universitaires de Saint Luc), explique plus en détails les résultats de Lynparza® de cette étude, dans une courte vidéo de 8 minutes.
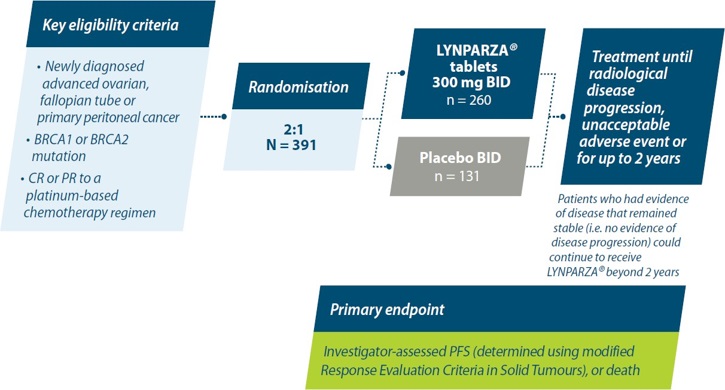
Conception de l’étude:
SOLO-1 a étudié la sécurité et l’efficacité de l’olaparib en traitement d’entretien chez les patientes atteintes d’un cancer de l’ovaire avancé nouvellement diagnostiqué (stades FIGO III-IV) endométrioïde ou séreux de haut grade présentant une mutation des gènes BRCA1/2 (BRCA1/2m) suite à une première ligne de chimiothérapie à base de platine dans le cadre d’une étude de phase III multicentrique, randomisée, en double aveugle et contrôlée par placebo.1,6
BID=twice daily; CR=complete response; BRCA1=breast cancer gene 1; BRCA2=breast cancer gene 2; n=number; PFS=progression-free survival; PR=partial response.
Résumé des résultats 2ième ligne
SOLO-2: Lynparza® monothérapie
SOLO-2 a étudié la sécurité et l’efficacité de l’olaparib en traitement d’entretien dans un essai de phase III randomisé, en double aveugle, contrôlé versus placebo conduit chez des patientes atteintes d’un cancer de l’ovaire endométrioïde ou séreux de haut grade, des trompes de Fallope ou péritonéal primitif, récidivant et sensible au platine (platinum-sensitive relapsed ou PSR) avec mutation germinale ou somatique des gènes BRCA1/2.1,8
Chez les femmes atteintes d'un cancer de l'ovaire séreux de haut grade récurrent sensible au platine Lynparza® a démontré une amélioration significative de la SSP chez les femmes atteintes d'un cancer sBRCAm ou gBRCAm.8
SOLO-2: Investigator-assessed PFS in women with a sBRCAm or gBRCAm8:
*All patients had a deleterious or suspected deleterious tumour BRCAm or gBRCAm as detected either by a local test (n=236) or by a central Myriad Clinical Laboratory Improvement Amendments test (n=59) subsequently confirmed by BRACAnalysis CDx® (n=286).
†The immature OS data showed no difference between the groups.
BICR=Blinded Independent Central Review; BRCAm=BRCA mutation; CI=confidence interval; gBRCAm=germline BRCAm; HR=hazard ratio; OS=overall survival; PFS=progression-free survival; PSR=platinum-sensitive recurrent.
Profil de sécurité
Le profil de sécurité observé dans l'étude SOLO-16 et le profil de sécurité à long terme dans le cadre du suivi SOLO-17 étaient conformes au profil de sécurité général de Lynparza®1.
AEs reported in ≥20% of patients in SOLO-1:
*Graded according to the National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0.
†The data include patients with anemia, a decreased hemoglobin level, a decreased hematocrit, a decreased red-cell count, erythropenia, macrocytic anemia, normochromic anemia, normochromic normocytic anemia, or normocytic anemia.
Le profil de sécurité observé dans l'étude SOLO-2 était conforme au profil de sécurité général de Lynparza®1,8.
Recherche de mutations
Les tests somatiques et germinaux effectués en parallèle permettent d'identifier un plus grand nombre de patientes susceptibles de bénéficier du traitement par Lynparza®.9
†% of woman with ovarian cancer who have BRCAm
Ressources et supports
Études cliniques
SOLO-1
Vidéos
Dr Luyckx discute les résultats de la SG après 7 ans de suivi
Le prof. Baurain discute des résultats de l’analyse primaire (suivi à 3 ans)
Publications
Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer
Moore K. et al. 2018 (initial publication)
Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial
Banerjee S. et al. 2022 (5-year follow-up publication)
Overall Survival With Maintenance Olaparib at a 7-Year Follow-Up in Patients With Newly Diagnosed Advanced Ovarian Cancer and a BRCA Mutation: The SOLO1/GOG 3004 Trial
DiSilvestro P. et al. 2022 (7-year follow-up publication)
MoA et recherche de mutations
Mécanisme d’action
Recherche de mutations
Site web: https://www.idbrca.com/ovarian-home.html
Pour vos patientes
Journal pour les patients traités par Lynparza
Événements
Aucun événement pour le moment.
Références
- LYNPARZA® 100 mg and 150 mg comprimés pelliculés, Résumé des caractéristiques du produit, version la plus récente
- https://ondpanon.riziv.fgov.be/SSPWebApplicationPublic/fr/Public/ProductSearch (accès 25/10/2021)
- Weston VJ et al. The PARP inhibitor olaparib induces signicant killing of ATM-decient lymphoid tumour cells in vitro and in vivo. Blood. 2010;116(22):4578–4587.
- Weil MK and Chen AP. PARP inhibitor treatment in ovarian and breast cancer. Curr Probl Cancer. 2011;35(1):7–50.
- Aly A and Ganesan S. BRCA1, PARP, and 53BP1: Conditional synthetic lethality and synthetic viability. J Mol Cell Biol. 2011;3(1):66–74.
- Moore K et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med. 2018;379(26):2495–2505.
- Banerjee S et al. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO-1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Oncology, 2021.
- Pujade-Lauraine E et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): A double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(9):1274–1284.
- Capoluongo E et al. Guidance statement on BRCA1/2 tumor testing in ovarian cancer patients. Semin Oncol. 2017;44:187–197.
- Vergote I et al. Current perspectives on recommendations for BRCA genetic testing in ovarian cancer patients. Eur J Cancer. 2016;69:127–134.
- Pennington et al. Germline and somatic Mutations in Homologous Recombination Genes Predict Platinum Response and Survival in Ovarian, Fallopian Tube, and Peritoneal Carcinomas Clin Cancer Res. 2014; 20(3):764–775.
- Pal T et al. BRCA1 and BRCA2 mutations account for a large proportion of ovarian carcinoma cases. Cancer. 2005;104(12):2807–2816.
- DiSilvestro P et al. Overall survival at 7-year follow-up in patients with newly diagnosed advanced ovarian cancer and a BRCA mutation who received maintenance olaparib in the SOLO1/GOG 3004 trial. Presented at ESMO Congress 2022, Paris, France, September 2022.
NS ID BE-2975-Revision date 12/2022-WEBLocal code 1697
.png)
.png)