Eierstokkanker
Highlights
Lynparza® terugbetaald in vroeg stadium borstkanker
Vanaf 1 juli 2023 is Lynparza® (olaparib) terugbetaald voor de adjuvante behandeling van volwassenen met hoog risico HER2-negatieve vroeg stadium borstkanker en een kiembaan BRCA1/2-mutatie, na het voltooien van een behandeling chemotherapie (anthracycline en/of taxaan) in de (neo-)adjuvante setting.
Voorschrijfinformatie
Terugbetaling in België
Vroeg stadium borstkanker:
Lynparza® (olaparib) is vergoed voor de adjuvante behandeling van volwassen patiënten met hoog risico HER2-negatieve vroeg stadium borstkanker en een kiembaan BRCA1/2-mutatie, na het voltooien van een behandeling chemotherapie (anthracycline en/of taxaan) in de (neo-)adjuvante setting. Het aantal vergoedbare verpakkingen zal rekening houden met een maximale posologie van 600 mg per dag, voor een periode van maximaal 12 maanden.
Klik hier [VE1] om een elektronische aanvraag in te dienen via het eHealth-platform. [VE1]Add link : https://idp.iamfas.belgium.be/fasui/chooseCredential/
Lokaal gevorderde of gemetastaseerde borstkanker:
Lynparza® (olaparib) is vergoed als monotherapie voor de behandeling van volwassen patiënten met lokaal gevorderde of gemetastaseerde triple negatieve (HER2-, ER-, PR-) borstkanker met kiembaan BRCA1/2-mutaties en die eerder zijn behandeld met een anthracycline en een taxaan in de (neo)adjuvante of gemetastaseerde setting (tenzij de rechthebbende niet geschikt was voor deze behandelingen).2[VE1] [VE1]This should be put as first subtitle underneath ‘Voorschrijfinformatie’
Dosering en toediening
Doseringsaanbevelingen voor Lynparza® filmomhulde tabletten1
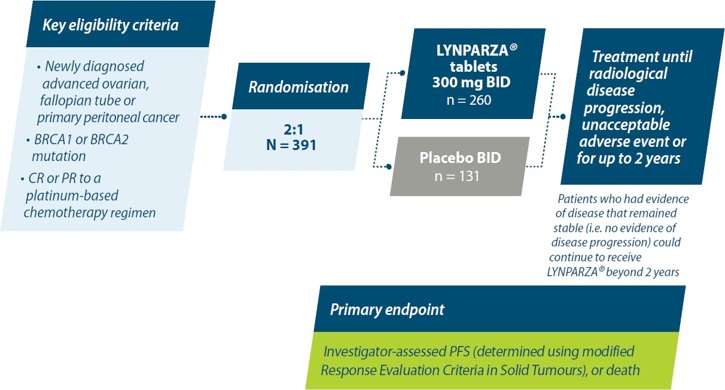
Olaparib komt voor vergoeding in aanmerking indien het wordt toegediend als monotherapie voor de onderhoudsbehandeling van volwassen patiënten met een nieuw gediagnosticeerd gevorderd BRCA-gemuteerd hooggradig epitheliaal ovarium-, tuba- of primair peritoneaal carcinoom die een respons vertonen na voltooien van eerstelijns platinabevattende chemotherapie.
Het betreft een patiënte2:
- Met een nieuw gediagnosticeerd FIGO stadium III of IV epitheliaal ovarium-, tuba- of primair peritoneaal carcinoom
- En met een bevestigde hooggradige histologie
- En een schadelijke of vermoedelijk schadelijke BRCA1 en/of BRCA2 mutatie (kiembaan en/of somatisch)
- En die niet meer dan 8 weken voor de aanvang van de behandeling met olaparib haar laatste dosis van de eerstelijns platinabevattende chemotherapie heeft voltooid
- En die een respons vertoond heeft op de recent beëindigde eerstelijns platinabevattende chemotherapie, nl.:
- ofwel een complete respons, zijnde geen meetbare ziekte op de beeldvorming na chemotherapie en een normaal CA-125 niveau,
- ofwel een partiële respons, zijnde > of = 30% afname in tumor volume tussen de start en het einde van de chemotherapie op beeldvorming of geen meetbare ziekte op de beeldvorming na chemotherapie en een CA-125 niveau dat niet gedaald is tot het normale niveau.
Olaparib komt voor vergoeding in aanmerking voor verderzetting na 2 jaar onderhoudsbehandeling volgens § 10210100 indien het verder wordt toegediend als monotherapie voor de onderhoudsbehandeling van deze patiënten met residueel stabiel hooggradig epitheliaal ovarium-, tuba- of primair peritoneaal carcinoom die een respons vertoonden na voltooien van eerstelijns platinabevattende chemotherapie.
Het betreft een patiënte:
- Waarvoor een gepaste medische beeldvorming (CT-scan of MRI), uitgevoerd op 2 jaar na de aanvraag tot terugbetaling volgens § 10210100, residueel stabiele ziekte heeft aangetoond en seriële CA-125 metingen geen herval van de ziekte aantonen
- En die naar mening van de behandelende arts verder voordeel kunnen behalen uit het voortzetten van de onderhoudsbehandeling met olaparib
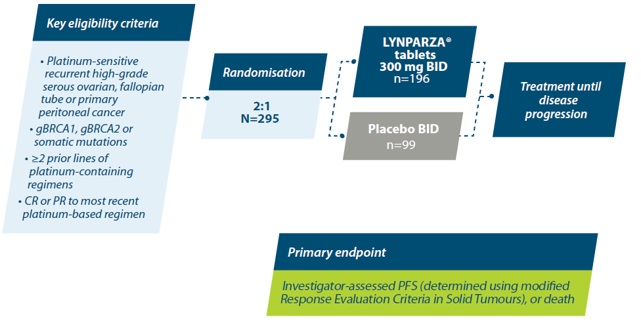
De farmaceutische specialiteit op basis van olaparib komt voor vergoeding in aanmerking volgens § 10950000 indien ze wordt toegediend als monotherapie in het kader van de onderhoudsbehandeling van volwassen rechthebbenden met een BRCA-gemuteerd platinagevoelig recidief hooggradig sereus of endometrioïd epitheliaal ovarium, tuba- of primair peritoneaal carcinoom, die nog nooit behandeld zijn met een farmaceutische specialiteit op basis van olaparib of een andere PARP-inhibitor in een voorafgaande lijn.
De rechthebbende moet minstens 2 voorafgaande lijnen platinabevattende chemotherapie gekregen hebben en een volledige of partiële respons vertonen (volgens RECIST criteria) op de laatst gekregen platinabevattende chemotherapie en dat tot het einde van de chemotherapie.
Het interval tussen de voorlaatste lijn platinabevattende chemotherapie en ziekteprogressie bedroeg minstens 6 maanden.
Het betreft:
- Een rechthebbende naïef voor behandeling met een farmaceutische specialiteit op basis van olaparib of een andere PARP-inhibitor. De rechthebbende mag niet meer dan 8 weken voor de aanvang van de behandeling met de betrokken farmaceutische specialiteit de laatste lijn platinabevattende chemotherapie hebben voltooid.
- OF een rechthebbende die een eerste machtiging gekregen heeft voor de farmaceutische specialiteit op basis van olaparib (§7770000) vóór de inwerkingtreding van de huidige reglementering.
Een schadelijke of vermoedelijk schadelijke BRCA mutatie (kiembaan en/of somatisch) moet aangetoond zijn door een erkend Centrum voor Menselijke Erfelijkheid of door een NGS-netwerk dat toegetreden is tot de overeenkomst met het RIZIV.
Klik hier om een elektronische aanvraag tot terugbetaling in te dienen via het eHealth platform.
Over Lynparza
Werkingsmechanisme
Olaparib is een sterke remmer van menselijke poly (ADP-ribose) polymerase-enzymen (PARP-1, PARP-2 en PARP-3) en het is aangetoond dat dit middel de groei van bepaalde tumorcellijnen in vitro en de groei van tumoren in vivo remt, ofwel als opzichzelfstaande behandeling of in combinatie met gevestigde chemotherapieën.1
Samenvattend: BRCA-gemuteerde (BRCAm) tumoren hebben een unieke moleculaire biologie die hen gevoelig maakt voor PARP-remming.3,4
Lynparza® remt PARP op twee manieren:*3-5
- Door de enzymatische activiteit te remmen3-5
- Door de vorming van gevangen PARP-DNA complexen te verhogen3-5
In vitro activity does not always correlate with clinical efficacy.
*The exact mechanism of action of LYNPARZA® remains a subject of research.
PARP=poly (ADP-ribose) polymerase; PARPi=poly (ADP-ribose) polymerase inhibitor.
Samenvatting van de resultaten in 1ste lijn
SOLO-1: Lynparza® monotherapie
Descriptieve OS-analyse na 7 jaar follow-up
Een klinisch relevant OS-voordeel werd waargenomen met olaparib versus placebo: 67% van de Lynparza® patiënten was in leven na 7 jaar vs 46.5% van de placebo patiënten.13
*P<0.0001 required to declare statistical significance. In order to preserve the statistical power of the final OS analysis, the alpha spending function required a p < .0001 to show statistical significance in the descriptive analysis (administrative alpha spending)13 BRCAm=BRCA-mutated; CI=confidence interval; HR=hazard ratio; mOS=median overall survival; OS=overall survival.
Time to first subsequent treatment (TFST): een onderhoudsbehandeling met Lynparza® vertraagde tijd tot eerstvolgende behandeling of dood vs. placebo. De mediane tijd tot eerstvolgende behandeling of dood was ruim 4 jaar met Lynparza® vs ruim 1 jaar met placeb
5-year analysis of progression-free survival7:
Lynparza® monotherapie: mediane PFS van >4,5 jaar bij patiënten met eierstokkanker in een vergevorderd stadium en BRCAm.6,7
Primaire PFS analyse na 3 jaar follow-up:
Hieronder bespreekt Professor Ignace Vergote (dienst Gynaecologische oncologie, UZ Leuven) in deze korte video van 7 minuten, de resultaten van Lynparza® in deze studie.
Study design:
SOLO-1 bestudeerde de veiligheid en werkzaamheid van onderhoudsbehandeling met olaparib bij patiënten met nieuw gediagnosticeerd, gevorderd (FIGO stadium III-IV) hooggradig sereus of endometrioïd BRCA1/2m ovariumcarcinoom na respons op eerstelijns platinabevattende chemotherapie in een gerandomiseerd, dubbelblind, placebogecontroleerd, multicentrisch fase III onderzoek.1,6
BID=twice daily; CR=complete response; BRCA1=breast cancer gene 1; BRCA2=breast cancer gene 2; n=number; PFS=progression-free survival; PR=partial response.
Samenvatting van de resultaten in 2e lijn
SOLO-2: Lynparza® monotherapie
SOLO-2 bestudeerde de veiligheid en werkzaamheid van een onderhoudsbehandeling met olaparib bij patiënten met kiembaan of somatisch BRCA1/2-gemuteerd platinasensitief recidiverend hooggradig sereus of endometrioïd ovarium-, tuba- of primair peritoneaal carcinoom in een gerandomiseerd, dubbelblind, placebogecontroleerd fase III-onderzoek.1,8
BID=twice daily; CR=complete response; gBRCA1=germline breast cancer gene 1; gBRCA2=germline breast cancer gene 2; n=number; PFS=progression-free survival; PR=partial response.
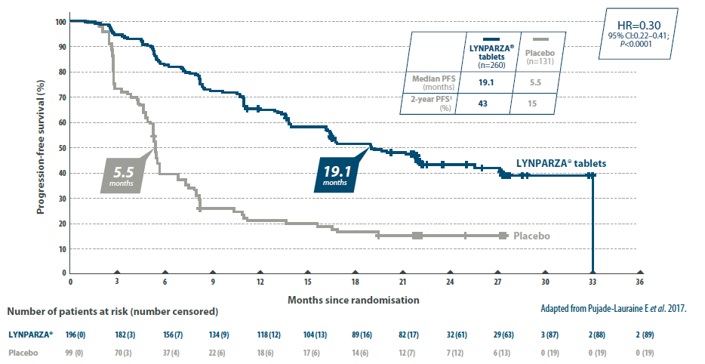
Bij vrouwen met recidiverende hooggradige platinumgevoelige sereuze eierstokkanker toonde Lynparza® een aanzienlijke verbetering van de PFS aan bij vrouwen met sBRCAm- of gBRCAm-kanker. 8
SOLO-2: Investigator-assessed PFS in women with a sBRCAm or gBRCAm8:
*All patients had a deleterious or suspected deleterious tumour BRCAm or gBRCAm as detected either by a local test (n=236) or by a central Myriad Clinical Laboratory Improvement Amendments test (n=59) subsequently confirmed by BRACAnalysis CDx® (n=286).
†The immature OS data showed no difference between the groups.
BICR=Blinded Independent Central Review; BRCAm=BRCA mutation; CI=confidence interval; gBRCAm=germline BRCAm; HR=hazard ratio; OS=overall survival; PFS=progression-free survival; PSR=platinum-sensitive recurrent.
Veiligheidsprofiel
Het veiligheidsprofiel dat werd waargenomen in SOLO-16 en het veiligheidsprofiel op lange termijn in de follow-up van SOLO-17 waren in overeenstemming met het algemene veiligheidsprofiel van Lynparza® 1.
AEs reported in ≥20% of patients in SOLO-1:
*Graded according to the National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0.
†The data include patients with anemia, a decreased hemoglobin level, a decreased hematocrit, a decreased red-cell count, erythropenia, macrocytic anemia, normochromic anemia, normochromic normocytic anemia, or normocytic anemia.
* Graded according to the National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0.
† Includes patients with fatigue and patients with asthenia.
‡ Includes patients with anaemia, haemoglobin decreased, haematocrit decreased, and red blood cell count decreased.
Onderzoek naar mutaties
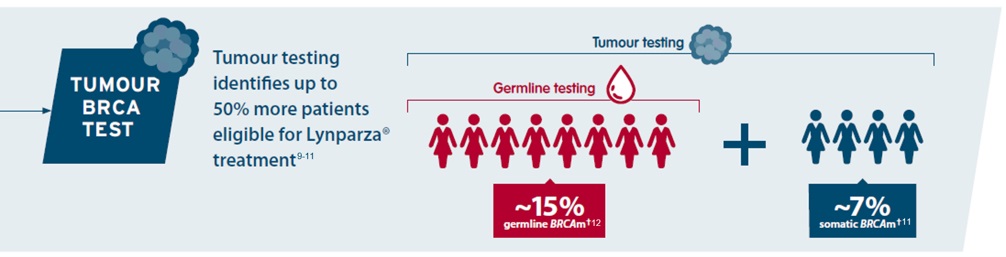
Dankzij parallelle somatische en kiembaantests kan een groter aantal patiënten worden geïdentificeerd die baat kunnen hebben bij een behandeling met Lynparza®9.
†% of woman with ovarian cancer who have BRCAm
Hulpbronnen en materialen
Klinische studies
Prof. Dr. van Dam bespreekt de OS-resultaten na 7 jaar follow-up
Video Prof. Vergote bespreekt de resultaten van de primaire analyse (3 jaar follow-up)
Publicaties
Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer
Moore K. et al. 2018 (initial publication)
Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial
Banerjee S. et al. 2022 (5-year follow-up publication)
Overall Survival With Maintenance Olaparib at a 7-Year Follow-Up in Patients With Newly Diagnosed Advanced Ovarian Cancer and a BRCA Mutation: The SOLO1/GOG 3004 Trial
DiSilvestro P. et al. 2022 (7-year follow-up publication)
MoA en onderzoek naar mutaties
Werkingsmechanisme
Onderzoek naar mutaties
Voor patiënten
Dagboek voor Lynparza patiënten
Evenementen
Momenteel zijn er geen evenementen.
Referenties
- LYNPARZA® 100 mg and 150 mg tabletten, samenvatting van de productkenmerken, meest recente versie
- https://ondpanon.riziv.fgov.be/SSPWebApplicationPublic/nl/Public/ProductSearch (bezocht 25/10/2021)
- Weston VJ et al. The PARP inhibitor olaparib induces signicant killing of ATM-decient lymphoid tumour cells in vitro and in vivo. Blood. 2010;116(22):4578–4587.
- Weil MK and Chen AP. PARP inhibitor treatment in ovarian and breast cancer. Curr Probl Cancer. 2011;35(1):7–50.
- Aly A and Ganesan S. BRCA1, PARP, and 53BP1: Conditional synthetic lethality and synthetic viability. J Mol Cell Biol. 2011;3(1):66–74.
- Moore K et al. Maintenance olaparib in patients with newly diagnosed advanced ovarian cancer. N Engl J Med. 2018;379(26):2495–2505.
- Banerjee S et al. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Oncology, 2021.
- Pujade-Lauraine E et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): A double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2017;18(9):1274–1284.
- Capoluongo E et al. Guidance statement on BRCA1/2 tumor testing in ovarian cancer patients. Semin Oncol. 2017;44:187–197.
- Vergote I et al. Current perspectives on recommendations for BRCA genetic testing in ovarian cancer patients. Eur J Cancer. 2016;69:127–134.
- Pennington et al. Germline and somatic Mutations in Homologous Recombination Genes Predict Platinum Response and Survival in Ovarian, Fallopian Tube, and Peritoneal Carcinomas Clin Cancer Res. 2014; 20(3):764–775.
- Pal T et al. BRCA1 and BRCA2 mutations account for a large proportion of ovarian carcinoma cases. Cancer. 2005;104(12):2807–2816.
- DiSilvestro P et al. Overall survival at 7-year follow-up in patients with newly diagnosed advanced ovarian cancer and a BRCA mutation who received maintenance olaparib in the SOLO1/GOG 3004 trial. Presented at ESMO Congress 2022, Paris, France, September 2022.
NS ID BE-2975-Revision date 12/2022-WEBLocal code 1697
.png)
.png)





.png)