BYDUREON® (exenatide)
Bydureon® (exenatide suspensie met verlengde afgifte voor injectie in voorafgevulde pen) is een eenmaal per week te injecteren receptoragonist van glucagonachtig peptide-1 (GLP-1), beschikbaar als pen met één dosis, geïndiceerd ter verbetering van de glykemische controle bij volwassenen met diabetes type 2. Beschikbaar als 2 mg poeder en oplosmiddel voor suspensie met verlengde afgifte voor injectie.
Over Bydureon
¶¶Het risico op hypoglykemie is groter wanneer de Bydureon pen wordt gebruikt in combinatie met een sulfonylureumderivaat of andere glucose-onafhankelijke secretagogen (bijv. meglitiniden). Artsen kunnen overwegen de dosis sulfonylureumderivaat te verlagen.
***Bydureon is niet geïndiceerd voor het beheersen van gewichtsverlies. In klinische onderzoeken waren veranderingen in het gewicht een secundair eindpunt.
†††Bydureon is niet geïndiceerd voor het beheersen van CVZ-gerelateerde risicofactoren, welke geen secundaire eindpunten waren in de klinische onderzoeken.
Farmacologische eigenschappen
Farmacokinetische eigenschappen van Bydureon
Evaluatie van het toevoegen van exenatide aan microbolletjestechnologie
Titel: Encapsulation of exenatide in poly-(D,L-lactide-co-glycolide) microspheres produced an investigational long-acting once-weekly formulation for Type 2 diabetes (Inkapseling van exenatide in poly-(D,L-lactide-co-glycolide) microsferen produceerde een onderzoekende langdurige wekelijkse formulering voor diabetes type 2)
Auteurs: DeYoung MB, MacConell L, Sarin V, et al.
Citaat: Diabetes Tech Ther 2011;13:1145–54
Bekijk het uittreksel van deze publicatie van DeYoung MB, et al. gepubliceerd in Diabetes Tech Ther
Farmacokinetica, werkzaamheid en veiligheid van Bydureon: ‘Proof of concept’-onderzoek
Titel: Effecten van eenmaal wekelijkse dosis van een verlengde afgifte formulering van exenatide op glucosebeheer en lichaamsgewicht bij proefpersonen met diabetes type 2
Auteurs: Kim D, MacConell L, Zhuang D, et al.
Citaat: Diabetes Care 2007;30:1487–93
Bekijk het uittreksel van deze publicatie van Kim D, et al. gepubliceerd in Diabetes Care
Werkingsmechanisme
Bydureon: De enige GLP-1 RA die microbolletjestechnologie gebruikt voor toediening eenmaal per week3, 19
Bydureon’s biologisch afbreekbare microbolletjestechnologie levert:
- Doorlopende, systemische blootstelling aan exenatide via een wekelijkse dosis3, 19
- Dynamische regulatie van glucosewaarden met minimale hoog-laag concentraties voor verbeterde verdraagbaarheid t.o.v. dagelijkse injecties3, 5, 12, 14
- Geen noodzaak voor titratie en de mogelijkheid tot aanpassing van injectiedag indien nodig7
Uniek toedieningssysteem maakt de constante aanwezigheid van exenatide mogelijk12, 19
BYDUREON eenmaal per week is ontworpen om constante behandelingshoeveelheden exenatide te leveren in een bepaalde periode12
Inkapselen door microbolletjes maakt de constante vrijgave van exenatide in een bepaalde periode mogelijk12
Overgenomen met toestemming uit DeYoung et al12
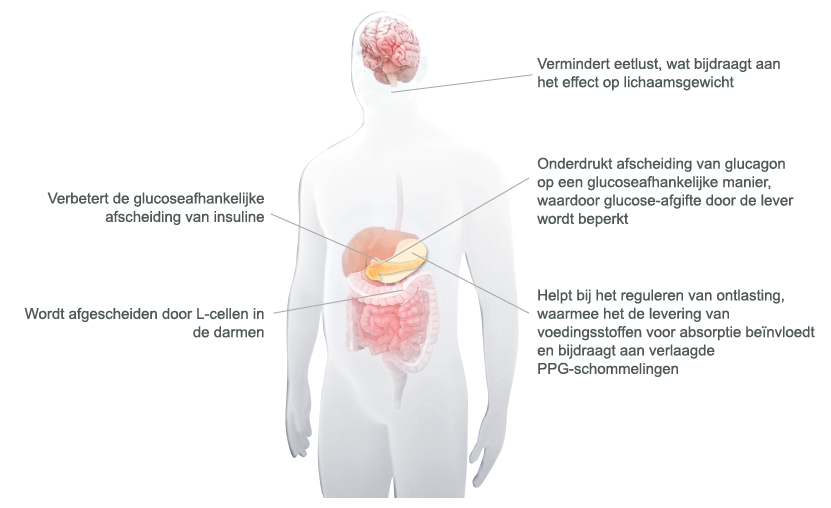
Bydureon werkt op een glucose-afhankelijke manier
Bydureon glucoseverlagende werking
GLP-1 werkt op meerdere plekken in het lichaam3, 20-22
- GLP-1 is een belangrijk incretine-hormoon dat een rol speelt in de glucose homeostase3, 20, 22
Patiëntenvoordelen
Behandeling met uitgebreide ervaring
Met meer dan ongeveer 4,1 miljoen patiëntenjaren23
Met meer dan 4,1 miljoen patiëntenjaren24
Afkortingen: GLP-1-RA, receptoragonist van glucagonachtig peptide-1
Klinische gegevens en lopende onderzoeken
- 170 afgeronde onderzoeken met resultaten voor exenatide25
- 73 lopende onderzoeken25
- >13.000 deelnemende patiënten aan lopende onderzoeken23
- 2242 verschillende publicaties26
- 7 jaar aan gegevens27, 28
- Ruim 12 jaar klinische ervaring met exenatide
Praktijk
- Wereldwijde ‘first-in-class’ GLP-1 RA
- Eerste wekelijkse diabetes type 2-behandeling
- Ruim 10 jaar ervaring in de praktijk
Bydureon pen is ontworpen om constante therapeutische exenatidespiegels te leveren in een bepaalde periode12
Bydureon pen levert therapeutische geneesmiddelspiegels, dag na dag, week na week5, 19
Door variaties in dosering, doseringsschema's en onderzoeksontwerp kan er geen directe vergelijking plaatsvinden met GLP-1 RA geneesmiddelen
Klinische relevantie is niet bekend
Afkortingen: SE, standaard fout
Bydureon pen is de enige GLP-1 RA formule met ingekapselde microsferen die zorgen voor verlengde en constante afgifte.3, 5
Opzet van het onderzoek
Het farmacokinetisch profiel van BYDUREON is vastgesteld in een 30 weken durend, gerandomiseerd, open-label, actief-comparator onderzoek. Plasmaconcentraties van exenatide werden gemeten bij 129 patiënten die BYDUREON ontvingen.5, 19
Significant betere naleving in vergelijking met dagelijks GLP-1 RA's29
Naleving van de behandeling met GLP-1 RA’s29
Kansratio met 95% BI (lager=slechtere naleving relatief aan exenatide QW)
‡‡‡P<0,001 voor exenatide QW t.o.v. comparators.
Waarschijnlijkheid van naleving aangepast aan multivariabele logistieke regressie (bereikte proportie van onderzochte dagen ≥ 90%) gedurende de 6 maanden durende opvolgingsperiode, met exenatide QW als referentiecategorie (n=22,838).29
66% van BYDUREON pen patiënten volgde de behandeling gedurende 3 jaar (156 weken) en 59% gedurende 5 jaar.6, 8
- Wekelijkse behandeling met de Bydureon pen kan de naleving sterker verbeteren dan sommige eenmaal daagse protocollen.29
Opzet van het onderzoek
GLP-1 RA-naïeve patiënten met diabetes type 2 die begonnen met een GLP-1 RA (exenatide BID, exenatide QW, of liraglutide QD) werden 6 maanden daarna gevolgd om de naleving van hun GLP-1 RA te meten en te vergelijken.29
Afkortingen: BID, tweemaal daags; GLP-1-RA, receptoragonist van glucagonachtig peptide-1; QD, eenmaal daags; QW, eenmaal per week
CGM onderzoek: Bydureon verminderde gemiddelde glucose gedurende de dag4
24 uur gemiddelde glucose op uitgangswaarde, week 4, en week 104
Gegevenscurves vertegenwoordigen een gemiddelde van iedere patiënt in het onderzoek. Geen afbeelding van tests bepaalde tijd na maaltijden genomen.
§§§Euglykemiewaarden in dit onderzoek zijn inclusief zowel FPG (nuchter plasmaglucose) als PPG (postprandiale glucose).
Significante afname in 24 uur gemiddelde glucoseconcentratie op 4 weken en 10 weken.4
Placebo-aangepaste afname in 24 uur gemiddelde glucoseconcentratie4:
- Op week 4: -17,8 mg/dl (P<0,001)
- Op week 10: -30,2 mg/dl (P<0,001)
Opzet van het onderzoek
Demografische gegevens uitgangswaarde patiënt (mITT): BYDUREON + MXR: 55% mannelijk; 86,7% Kaukasisch; gemiddelde duur diabetes type 2, 9,01 jaar; gemiddeld HbA1c, 8,17%; gemiddeld FPG, 178 mg/dl; gemiddeld 2 uur PPG, 221,6 mg/dl. Placebo + MXR: 57% mannelijk; 82% Kaukasisch; gemiddelde duur diabetes type 2, 9,92 jaar; gemiddeld HbA1c, 7,98%; gemiddeld FPG, 167,5 mg/dl; gemiddelde 2 uur PPG, 221,6 mg/dl.4
Een gerandomiseerd dubbelblind onderzoek waarbij BYDUREON wordt vergeleken met placebo in 116 patiënten met diabetes type 2, in de leeftijd van ≥18 jaar en ≤75 jaar, behandeld met een stabiele dosis MXR (≥1500 mg/dag gedurende ten minste 8 weken) met inadequate glykemische controle (HbA1c ≥7% en ≤10%). Na de opstartperiode van 4 weken, waarin patiënten werden behandeld met open-label MXR, werden patiënten gerandomiseerd 1:1 om hetzij BYDUREON (2 mg) + MXR te ontvangen of een placebo + MXR. Een CGM systeem werd gebruikt om de 24 uur glucoseconcentratie te meten tijdens de opstartperiode (dag -8 en dag -1), week 4 (dag 21 tot 28), en opnieuw tijdens week 10 (dag 63 tot 70) van de behandeling. Het onderzoek werd afgesloten met een 4 weken durende opvolging voor veiligheid. Primair eindpunt was verandering in de 24 uur gemiddelde glucoseconcentratie vanaf de uitgangswaarde na 4 en 10 weken behandeling. Secundaire eindpunten beoordeeld na 4 en 10 weken behandeling waren onder andere: FPG, 2 uur PPG, en het tijdsaandeel dan patiënten hypoglykemisch waren (>180 mg/dl), de hypoglykemische (<70 mg/dl), of euglykemische waarde (≥70 tot ≤180 mg/dl—waarde is inclusief de nuchtere en postprandiale periodes).4
Bydureon verlengde de duur van de euglykemische waarde in vergelijking met uitgangswaarde4
Aandeel (%) van tijd van de euglykemische waarde (≥70 tot ≤ 180 mg/dl) op uitgangswaarde, 4 weken, en 10 weken4
- Al na 4 weken, en na 10 weken, had BYDUREON de blootstelling van patiënten aan bloedglucoseconcentraties verlaagd tot buiten de euglykemische waarden (>180 mg/dl en <70 mg/dl) vergeleken met uitgangswaarde gedurende de 24 uur periode4
- BYDUREON vertoonde constante verbetering vanaf de uitgangswaarde, waarbij patiënten 77% van de dag binnen euglykemische waarden zatenǁǁǁ op 10 weken4
- Tijd doorgebracht met hypoglykemische waarden nam niet significant toe na 4 en 10 weken4
ǁǁǁEuglykemiewaarden in dit onderzoek zijn inclusief zowel FPG als PPG.
Opzet van het onderzoek
Demografische gegevens uitgangswaarde patiënt (mITT): BYDUREON + MXR: 55% mannelijk; 86,7% Kaukasisch; gemiddelde duur diabetes type 2, 9,01 jaar; gemiddeld HbA1c, 8,17%; gemiddeld FPG, 178 mg/dl; gemiddeld 2 uur PPG, 221,6 mg/dl. Placebo + MXR: 57% mannelijk; 82% Kaukasisch; gemiddelde duur diabetes type 2, 9,92 jaar; gemiddeld HbA1c, 7,98%; gemiddeld FPG, 167,5 mg/dl; gemiddelde 2 uur PPG, 221,6 mg/dl.4
Een gerandomiseerd dubbelblind onderzoek waarbij BYDUREON wordt vergeleken met placebo in 116 patiënten met diabetes type 2, in de leeftijd van ≥18 jaar en ≤75 jaar, behandeld met een stabiele dosis MXR (≥1500 mg/dag gedurende ten minste 8 weken) met inadequate glykemische controle (HbA1c ≥7% en ≤10%). Na de opstartperiode van 4 weken, waarin patiënten werden behandeld met open-label MXR, werden patiënten gerandomiseerd 1:1 om hetzij BYDUREON (2 mg) + MXR te ontvangen of een placebo + MXR. Een CGM systeem werd gebruikt om de 24 uur glucoseconcentratie te meten tijdens de opstartperiode (dag -8 en dag -1), week 4 (dag 21 tot 28), en opnieuw tijdens week 10 (dag 63 tot 70) van de behandeling. Het onderzoek werd afgesloten met een 4 weken durende opvolging voor veiligheid. Primair eindpunt was verandering in de 24 uur gemiddelde glucoseconcentratie vanaf de uitgangswaarde na 4 en 10 weken behandeling. Secundaire eindpunten beoordeeld na 4 en 10 weken behandeling waren onder andere: FPG, 2 uur PPG, en het tijdsaandeel dan patiënten hypoglykemisch waren (>180 mg/dl), de hypoglykemische (<70 mg/dl), of euglykemische waarde (≥70 tot 180 mg/dl—waarde is inclusief de nuchtere en postprandiale periodes).4
Bydureon verbeterde ppg en fpg t.o.v. uitgangswaarde na 4 weken en 10 weken4
2 uur PPG: Significante afname na 4 weken en 10 weken4
FPG: Significante afname na 4 weken en 10 weken4
Gegevens zijn gemiddelde +/- SE op dag 2 van elke week.
Analyse van herhaalde metingen.
CGM onderzoek: BYDUREON gaf constante afname van FPG.4
Opzet van het onderzoek
Demografische gegevens uitgangswaarde patiënt (mITT): BYDUREON + MXR: 55% mannelijk; 86,7% Kaukasisch; gemiddelde duur diabetes type 2, 9,01 jaar; gemiddeld HbA1c, 8,17%; gemiddeld FPG, 178 mg/dl; gemiddeld 2 uur PPG, 221,6 mg/dl. Placebo + MXR: 57% mannelijk; 82% Kaukasisch; gemiddelde duur diabetes type 2, 9,92 jaar; gemiddeld HbA1c, 7,98%; gemiddeld FPG, 167,5 mg/dl; gemiddelde 2 uur PPG, 221,6 mg/dl.4
Een gerandomiseerd dubbelblind onderzoek waarbij BYDUREON wordt vergeleken met placebo in 116 patiënten met diabetes type 2, in de leeftijd van ≥18 jaar en ≤75 jaar, behandeld met een stabiele dosis MXR (≥1500 mg/dag gedurende ten minste 8 weken) met inadequate glykemische controle (HbA1c ≥7% en ≤10%). Na de opstartperiode van 4 weken, waarin patiënten werden behandeld met open-label MXR, werden patiënten gerandomiseerd 1:1 om hetzij BYDUREON (2 mg) + MXR te ontvangen of een placebo + MXR. Een CGM systeem werd gebruikt om de 24 uur glucoseconcentratie te meten tijdens de opstartperiode (dag -8 en dag -1), week 4 (dag 21 tot 28), en opnieuw tijdens week 10 (dag 63 tot 70) van de behandeling. Het onderzoek werd afgesloten met een 4 weken durende opvolging voor veiligheid. Primair eindpunt was verandering in de 24 uur gemiddelde glucoseconcentratie vanaf de uitgangswaarde na 4 en 10 weken behandeling. Secundaire eindpunten beoordeeld na 4 en 10 weken behandeling waren onder andere: FPG, 2 uur PPG, en het tijdsaandeel dan patiënten hypoglykemisch waren (>180 mg/dl), de hypoglykemische (<70 mg/dl), of euglykemische waarde (≥70 tot ≤180 mg/dl—waarde is inclusief de nuchtere en postprandiale periodes).4
Andere
Bydureon-injectieapparaat – ontwikkeling en bruikbaarheid
Bruikbaarheidsonderzoek van het Bydureon injectieapparaat met één dosis
Titel: Pplication of adult-learning principles to patient instructions: A usability study for an exenatide once-weekly injection device
Auteurs: Lorenzi G, Schreiner B, Osther J, Boardman M
Citaat: Clin Diabetes 2010;28:157–62
Bekijk het uittreksel van deze publicatie van Lorenzi G, et al. gepubliceerd in Clin Diabetes
Medische noodzaak
Zowel FPG als PPG dragen bij aan HbA1c30
PPG draagt meer bij aan totale hyperglykemie dan FPG aan lage HbA1c spiegels¶¶¶30
Overgenomen met toestemming van Monnier et al
PPG schommelingen leveren een grote bijdrage aan de totale glykemische last van patiënten met licht tot matige hyperglykemie.30
Opzet van het onderzoek
Observatieonderzoek (n=290) van patiënten die ten minste 3 maanden zijn behandeld met alleen dieet, metformine, glyburide, of beide. Inclusiecriteria zijn inclusief een ≥6 maanden voorgeschiedenis van diabetes type 2 en geen huidige behandeling met hetzij insuline of acarbose. Patiënten werden ingedeeld op basis van gemiddeld HbA1c (%), en een 1-daagse analyse werd uitgevoerd op 4 punten van nuchtere en postprandiale plasmaglucoseconcentraties na toepassing van een gestandaardiseerd dieet.30, 31
¶¶¶Patiënten werden behandeld met enkel dieet, metformine, glyburide, of een combinatie van metformine en glyburide.
Basale insuline mogelijk niet voldoende om PPG verhogingen aan te pakken32
PPG en FPG relatieve bijdragen aan hyperglykemie na 24 of 28 weken behandeling met basale insuline32
Overgenomen met toestemming van Riddle et al.
PPG blijft mogelijk verhoogd en draagt bij aan algehele hyperglykemie zelfs bij patiënten die behandeld worden met basale insuline32
Veel patiënten bereiken nog steeds hun HbA1c doelen niet na behandeling met basale insuline.33, 34
Opzet van het onderzoek
Uitgangswaarde en week 24a gegevens uit 6 onderzoeken met patiënten (n=1699) met diabetes mellitus type 2 suboptimaal beheerst (HbA1c > 7%) en behandeld met orale anti-hyperglykemische geneesmiddelen werden gecombineerd voor analyse. Uitgangswaarde gemiddelde HbA1c was 8,7% voor de patiëntpopulatie voorafgaand aan behandeling escalatie met basale insuline (n=1261). Nuchtere plasmaglucose en PPG concentraties werden afgeleid uit metingen voor en 2 uur na iedere maaltijd en bij bedtijd.32
aPatiëntgegevens van één onderzoek werden niet beoordeeld na 24 weken. Dit werd vervangen door gegevens na achtentwintig weken.32